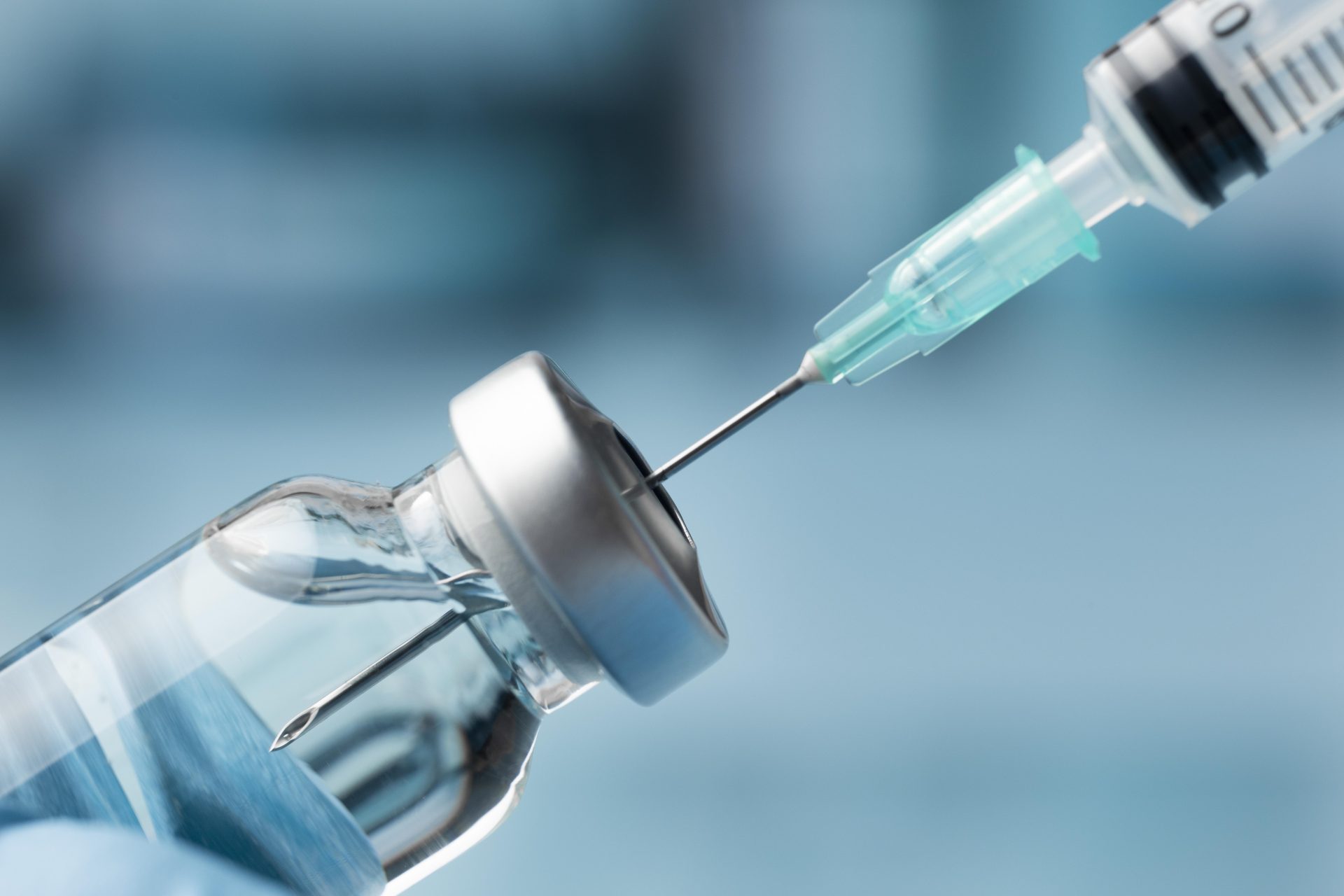
O primeiro medicamento injetável contra o Vírus da Imunodeficiência Humana (HIV) no país foi aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa).
O medicamento é o ‘cabotegravir’, consistindo em uma profilaxia pré exposição (PrEP). A função da dose é prevenir contra eventuais infecções pelo vírus em específico.
+ Envie esta notícia no seu WhatsApp
+ Envie esta notícia no seu Telegram
A permissão foi dada à farmacêutica britância GSK. No início deste mês, o registro do medicamento foi publicado no Diário Oficial da União (DOU). Porém, a data para a comercialização no Brasil ainda não foi divulgada.
A injeção recebeu a autorização da FDA (Food and Drug Administration), agência reguladora de saúde dos Estados Unidos, em 2021.
Em 2022, a Organização Mundial da Saúde (OMS) também recomendou como parte de uma abordagem extensiva para a prevenção do HIV.
Diferença do medicamento atual
O diferencial entre o cabotegravir e os remédios usados atualmente é que o novo medicamento é injetável e possui uma ação prolongada.
As duas primeiras doses são aplicadas com quatro semanas de intervalo, seguidas de um tratamento com uma injeção a cada oito semanas.
Já terapias conhecidas como PrEP são de uso oral e os comprimidos precisam ser tomados diariamente.
Após ensaios clínicos, pesquisadores constataram a eficácia 69% maior em comparação com os remédios orais.
RELACIONADAS
+ MPF aciona Justiça contra veto a pessoas com HIV em concursos do Exército no AM
+ Dia Mundial de Luta contra a Aids terá testagem para HIV em Manaus
+ Mais um paciente com HIV é curado após transplante de células-tronco